Atendiendo al estudio y la solución de la degeneración axonal en la córnea, nuestros proyectos de investigación durante 2016 fueron:
PROYECTO 1. DEGENERACIONES AXONALES DEBIDAS A FACTORES ENDÓGENOS: ENVEJECIMIENTO Y ENFERMEDADES NEURODEGENERATIVAS
A) ENVEJECIMIENTO
El proceso de envejecimiento natural afecta a todos los tejidos de manera progresiva. El sistema nervioso no es una excepción. Las personas mayores pierden visión, oído, percepción olfativa e incluso gusto. Pero también ven disminuída su sensibilidad general. Tacto fino, temperatura y dolor son sensaciones que se ven alteradas con la edad. En muchas ocasiones un estímulo normalmente inocuo se convierte en una sensación dolorosa y molesta, lo que denominamos alodinia. Normalmente se considera que a medida que envejecemos, perdemos un número importante de receptores sensitivos y que esta es la causa de la disfunción sensorial. Algunas patologías como la diabetes pueden acelerar la degeneración de los nervios y agravar el proceso, llegando incluso a producir úlceras crónicas y dolorosas en la piel.
Sin embargo, no todas las estructuras parecen ser igualmente vulnerables al envejecimiento. En nuestro laboratorio hemos estudiado la inervación sensorial de la superficie ocular en ratones envejecidos y nos hemos centrado en el análisis de los receptores sensitivos de frío por su especial importancia en la regulación de la producción de lágrima. Hemos identificado y caracterizado funcional y molecularmente dos poblaciones de neuronas receptoras de frío que presentan el canal iónico TRPM8 en la córnea. Además, estos dos tipos de neuronas tienen funciones diferentes. El primer tipo tiene un papel regulador de la producción de lágrima y creemos que contribuye al bloqueo del dolor inhibiendo otras neuronas polimodales. El segundo tipo tiene características típicas de un nociceptor clásico. Atendiendo únicamente a estos dos tipos de fibras nerviosas de la córnea, observamos que el envejecimiento afecta de manera diferente a cada uno de ellos, con interesantes procesos degenerativos singulares en las aferencias corneales: la degeneración asociada a la edad de las fibras de frío se da casi exclusivamente en el primero de los dos tipos de fibras, mientras que el otro no está afectado significativamente. La desaparición selectiva del tipo “regulador” de fibras TRPM8 se asocia con la disfunción de la producción de lágrima. El tipo “nociceptor” de fibras TRPM8 que permanecen presentes en los animales más viejos expresan marcadores de dolor e inflamación. Según nuestra hipótesis, éstas últimas serían las responsables de la aparición de las sensaciones molestas y dolorosas que acompañan a la disfunción lagrimal en los pacientes de avanzada edad. Así, en los animales envejecidos encontramos una actividad eléctrica en una población de terminales de frío que se parece a la de las fibras reguladoras (que en condiciones normales tienen una actividad basal constante) pero con una intensidad de respuesta superior y más prolongada, similar a la de las fibras polimodales.
De esta manera hemos podido relacionar directamente la pérdida selectiva de fibras nerviosas en la córnea con la disfunción lagrimal asociada a la edad en un modelo que refleja fielmente los signos patológicos del ojo seco: disfunción lagrimal, inflamación y dolor.
La actividad dual del canal TRPM8 lo define como diana terapéutica para la solución del dolor neuropático e inflamatorio.
Por otro lado, comprender cuál es la razón por la que un tipo de neuronas tan restringido presenta una mayor vulnerabilidad a la degeneración, abre vías para el diseño de terapias neuroprotectoras.
PUBLICACIONES CIENTÍFICAS
NUEVA DIANA TERAPÉUTICA PARA CASOS DE OJO SECO
B) ENFERMEDADES NEURODEGENERATIVAS
En estrecha relación con el envejecimiento se encuentran las enfermedades neurodegenerativas. En la actualidad se considera que las enfermedades neurodegenerativas son enfermedades sistémicas con sintomatología y afectación predominante en el sistema nervioso central. Las evidencias clínicas que definen una enfermedad neurodegenerativa suelen ser déficits cognitivos o motores severos, detectados en edades avanzadas. Sin embargo, el inicio y el progreso de la enfermedad ocurre en etapas mucho más tempranas de la vida. Los procesos de plasticidad neural y sináptica del cerebro ocultan la progresión de la patología y mantienen la funcionalidad cognitiva y motora hasta un punto de inflexión tardío. En algunas enfermedades neurológicas como el Parkinson, se pueden detectar altos niveles de α-sinnucleína (un biomarcador de la enfermedad) en biopsias de colon hasta 15 años antes de la presentación de los primeros síntomas motores.
En la enfermedad de Alzheimer se pueden detectar también neuropatías periféricas en biopsias de piel de los enfermos. En modelos animales de enfermedades neurodegenerativas hemos observado que el ojo es extremadamente vulnerable a las enfermedades sistémicas, como por ejemplo en el caso de la encefalopatía hepática. Tanto la retina como la inervación de la córnea podrían mostrar signos precoces de degeneración nerviosa, previos a la aparición de las deficiencias cognitivas típicas de la enfermedad neurológica. En nuestro caso, hemos observado que ratones con patologías neurodegenerativas presentan ciertas neuropatías en la córnea. Los axones distróficos, en este caso, muestran similitudes tanto con procesos “Dying back” como con degeneraciones anterógradas similares a degeneración Walleriana.
Esta mezcla de mecanismos podría indicar una afectación neuronal directa, que a su vez está sustentada por la presencia de la proteína TAU hiperfosforilada en el soma y el axón.
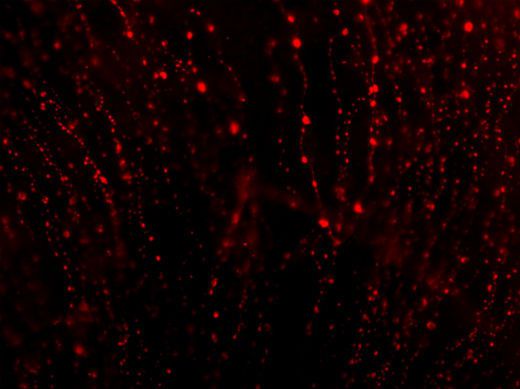
Figura 1: Vista de las fibras nerviosas distróficas de la córnea de un ratón APP/PS1. Nótese la elevada cantidad de varicosidades.
PROYECTO 2. REGENERACIÓN EN LESIONES NERVIOSAS INDUCIDAS: MECANISMOS DE REGENERACIÓN NERVIOSA Y NEUROPROTECCIÓN.
A) ESTUDIO DE LA REGENERACIÓN NERVIOSA EN LESIONES QUIRÚRGICAS EXPERIMENTALES.
Utilizando un modelo propio de lesión de la córnea por ablación láser (cirugía foto-refractiva o PRK) podemos producir una lesión por axotomía de todo el plexo nervioso subbasal de la córnea. A lo largo de un periodo de 3 meses se estudian los parámetros morfológicos de regeneración, su relación con la cicatrización del tejido y la recuperación de la función anterior a la lesión. Estos resultados serán muy valiosos para diseñar terapias dirigidas a la reparación corneal y al alivio del dolor postquirúrgico. La implicación en la regeneración nerviosa de otros tipos celulares no nerviosos tales como la glía, los fibroblastos y las células inflamatorias, es muy poco conocida tanto en la literatura como en la práctica clínica. Es importante también conocer el cambio en el ambiente extracelular durante la regeneración y su implicación en los casos de regeneración aberrante. El establecimiento de los parámetros basales de la regeneración nos sirve de origen para la experimentación de diferentes estrategias regenerativas.
La velocidad de regeneración en la córnea depende de la existencia de un sustrato adecuado para la emisión de neuritas y de la presencia de las dianas terminales de los receptores. En nuestros experimentos, generalmente no encontramos axones en regeneración con anterioridad a la completa reepitelización del área lesionada, que suele ocurrir entre los 3 y los 4 días después de la lesión. A los tres meses de recuperación, la inervación de la superficie de la córnea tiene una apariencia normal, observándose incluso la formación de un vórtex apical nervioso. La actividad electrofisiológica en esta etapa es normal.
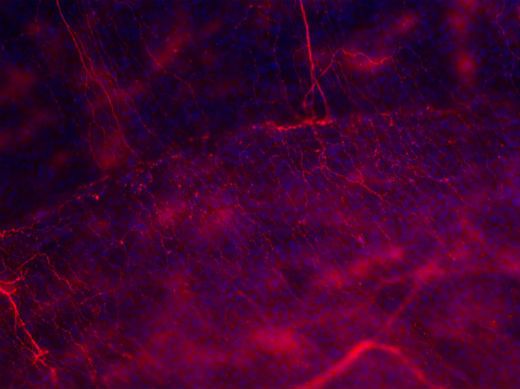
Figura 2: Vista de la región periférica de la lesión corneal donde se observa la ramificación y prolongación de los axones en regeneración hacia el centro de la córnea (situado en la esquina inferior derecha de la imagen)
B) ESTUDIO DE LA LESIÓN NERVIOSA INDUCIDA POR RADIACIÓN LUMINOSA.
A parte de las lesiones nerviosas traumáticas o quirúrgicas que afectan masivamente a la inervación sensorial de la córnea, otros muchos agentes externos pueden ser considerados factores de degenearción exógenos en la córnea. La radiación luminosa de una determinada longitud de onda, por ejemplo, ha sido descrita como inductora o potenciadora de degeneración y muerte celular en células de la retina, sobre todo si la retina sufre un estado patológico.
En nuestro laboratorio hemos comprobado que la córnea también se ve afectada por la radiación lumínica y que daña preferentemente elementos nerviosos. Concretamente, hemos reconocido estructuras degenerativas en los axones coincidentes con mecanismos de degeneración “Dying back”. Nuestra hipótesis, compartida con el Dr. Neville Osborne, es que la luz interfiere en la actividad normal de la cadena respiratoria de la mitocondria, reduciendo su capacidad de respuesta frente al estrés oxidativo.
La acumulación de especies reactivas del oxígeno (ROS) produce el deterioro de la función mitocondrial, necesaria para la actividad normal de la neurona. En el ambiente local del axón, los microtúbulos se desestabilizan a consecuencia del déficit mitocondrial y la fosforilación de TAU, agrupándose en engrosamientos de la membrana (varicosidades) a lo largo del axón. El tráfico vesicular a lo largo del axón se ve interrumpido y finalmente la membrana plasmática del axón se reabsorbe, originando esférulas degenerativas. La función de la fibra nerviosa se pierde.
Una vez comprendamos este escenario, el siguiente paso será la aplicación de terapias neuroprotectoras para inhibir o prevenir el daño inducido exógenamente. Una neuroprotección eficaz produciría el rescate de las fibras que se ven afectadas por el envejecimiento, por ejemplo.


